
Implantes de mama texturizados recuperados devido ao vínculo com o câncer

Allergan Inc. Na semana passada, voluntariamente convocou vários modelos de implantes mamários texturizados após a preocupação de que eles pudessem estar ligados a uma forma rara de câncer, o linfoma anaplásico de células grandes associado a implantes mamários, veio à tona, de acordo com um comunicado. A Food and Drug Administration instou a empresa a retirar alguns de seus implantes e expansores de tecido do mercado depois que novas informações revelaram um número desproporcional de casos de BIA-ALCL em pessoas com os produtos.
BIA-ALCL, um tipo de linfoma não Hodgkin, tem sido fortemente associado a implantes texturizados, que representam menos de 5 por cento dos implantes vendidos na U.S., de acordo com o FDA. A maioria dos implantes vendidos nos Estados Unidos tem superfícies lisas, mas os implantes Biocell da Allergan apresentam uma superfície macro texturizada que é exclusiva da empresa.
“Embora a incidência geral de BIA-ALCL pareça ser relativamente baixa, uma vez que as evidências indicaram que o produto de um fabricante específico parecia estar diretamente relacionado a danos significativos ao paciente, incluindo morte, o FDA tomou medidas para alertar a empresa sobre novas evidências indicando um a retirada é garantida para proteger a saúde das mulheres, ”a Vice-Comissária Principal da FDA, Amy Abernethy, M.D., Ph.D., disse em um comunicado. Ela acrescentou que o FDA tem monitorado a associação entre implantes mamários e BIA-ALCL desde 2011.
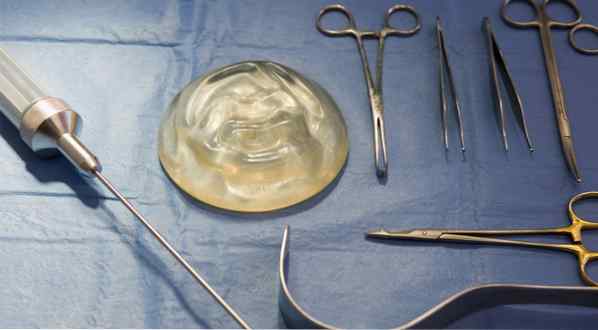
Tudo o que você precisa saber sobre implantes mamários
Faça sua pesquisa antes de assumir esse compromisso robusto.
Leia o artigoO FDA solicitou o recall depois que uma análise atualizada descobriu que de 573 pessoas com BIA-ALCL em todo o mundo, 481 supostamente tinham implantes mamários Allergan. Considerando os novos dados, a análise do FDA diz que o risco de BIA-ALCL naqueles com implantes Allergan Biocell é seis vezes maior do que naqueles com implantes texturizados de outros fabricantes. BIA-ALCL é geralmente encontrado no tecido cicatricial e fluido perto de um implante.
A notícia pode ser desconcertante para quem já tem os implantes agora recuperados, mas o FDA não está pedindo sua remoção em pacientes assintomáticos. O anúncio sobre o recall serve simplesmente para alertar os pacientes e médicos sobre a conexão.
“Avaliaremos continuamente qualquer nova informação e podemos, como resultado, tomar medidas em relação a outros implantes mamários, se necessário,” Jeff Shuren, M.D., J.D., diretor do Centro de Dispositivos e Saúde Radiológica do FDA, disse. “Além disso, continuamos nossa avaliação para determinar se o risco de desenvolver BIA-ALCL é limitado a modelos específicos de implantes mamários texturizados ou todos os implantes mamários texturizados. Continuamos aconselhando mulheres e profissionais de saúde que o uso de implantes mamários está associado ao risco de desenvolver BIA-ALCL e que o risco é maior com implantes texturizados.”
Mais uma vez, o FDA não está aconselhando aqueles sem sintomas a removerem os implantes em recall, mas fornece uma lista com marcadores de informações e recomendações importantes para aqueles que os possuem. Obtenha a lista completa no final de o comunicado de imprensa da FDA.gov, e diga ao seu médico se você tiver dúvidas sobre implantes.

As mulheres estão recorrendo às redes sociais para reivindicar seus ..
Mais e mais mulheres estão compartilhando suas histórias nas redes sociais.
Leia o artigo


Ainda sem comentários